
機械機器とコンピューター効果操作の紹介と21 CFRパート11
ISPEによって策定されたGAMPとGMPは異なり、強制的な規範や標準には属さず、理論と実践の方法に関するガイドラインです。 それは規範に属さず、ISPEも認証機関に属さないため、GAMPでも次のように声明されています:"GAMP認証を受けた"または"GAMPの承認を得た"と主張することは不適切です。
しかし、GAMP5が提唱する多くの理論や概念は非常に科学的で理にかなっているため、法規には属さないものの、現在の国際製薬業界におけるコンピュータシステムの検証方法の主要な参考基準であり、医薬品自動化において最も重要な規制ガイドラインでもあります。
1. プロセス
コンピュータシステムの検証は、システムの利用プロセスに限定されるものではなく、新しいシステムの初期定義・設計段階から検証を開始し、システムの利用価値がなくなった時点で検証を終了する必要があります。検証ライフ サイクル (SVLC) は、システム開発ライフ サイクル (SDLC) 全体に付随する必要があります。
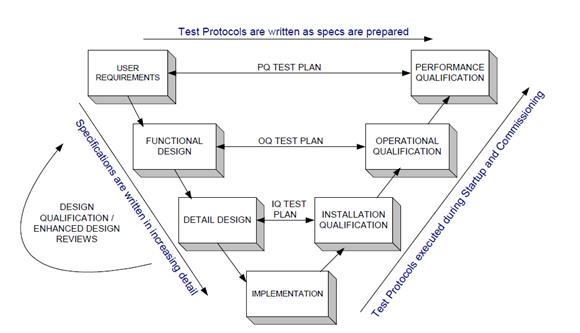
システム開発のライフサイクルは以下の8つの段階に分けることができます:
1. 実現可能性調査
2. プロジェクト計画
3. 要件定義
4. システム設計
5. システムテスト
6. システム受け入れと確認
7、 使用とメンテナンス
8、 システムの引退
2. インフラストラクチャー
GAMP 5におけるコンピュータシステムソフトウェアの分類
第1カテゴリのソフトウェア:インフラストラクチャソフトウェア(Infrastructure Software)
第3カテゴリのソフトウェア:設定不可ソフトウェア(Non-Configured Products)
第4カテゴリのソフトウェア:設定可能ソフトウェア(Configured Products)
第5カテゴリのソフトウェア:カスタムアプリケーションソフトウェア(Custom Application)
コンピュータシステムハードウェアの分類
第1カテゴリのハードウェア:標準ハードウェアコンポーネント(Standard Hardware Components)(現在、ほとんどのものがこのカテゴリのハードウェアを使用しています)
第2種ハードウェア:カスタムビルドハードウェアコンポーネント(これらのハードウェアは特定のニーズを満たすために開発され、標準ハードウェアコンポーネントの補完となります)
3. 検証
システムの受け入れテストと検証は、最終的なコンピューターシステムと関連するファイルがユーザーに提供され、ユーザー環境でインストールされ、機能の正確性が評価される際に行われます。
検証(「インストール検証」、「実行検証」、および「性能検証」)は、コンピュータシステムが実際に使用される前に行われる完全かつ体系的なテスト行為であり、コンピュータシステムの使用品質に直接影響を与えます。 つまり、「検証」はコンピュータシステムの品質保証の最後のステップです。 「検証」の一部はユニットテストと組み立てテストの同じ条件下で行われ、使用されるデータも同じですが、「検証」は依然として必要です。
〝検証〞は一般的にユーザーによって実行されます。
検証の主なアクション
1、 承認されたプロトコルを実行する
2、 実行結果を観察する
3、 観察意見を記録する
4、 実行報告書を作成する
5、 報告書を承認するか、変更管理プロセスに従って再実行する(修正または承認)
四、21 CFR Part 11

元成機械は21 CFR Part 11に準拠した文書を提供できます
CFR:連邦規則集
21 CFR Part 11、すなわちアメリカ合衆国連邦規則第21章第11項は、この規範の主な目的が文書内容に関連する電子記録および電子署名に関する具体的な規定を定めることである。
連邦規則第21章第11項
電子記録;電子署名
章A 一般規定
11.1 適用範囲
11.2 履行
11.3 定義
第 B 章 電子記録
11.10 閉じたシステムの制御
11.30 開放システムの制御
11.50 署名の検証
11.70 署名/記録の接続
第 C 章 電子署名
一般条項
電子署名と管理
コントロールID/パスワード
元成機械設備は上記のサービスを提供できます。
GAMP5および21 CFR Part 11からの参照
元成機械会社概要
元成機械股份有限公司は台湾の製薬機械業界に特化したバイオ医薬品設備の製造業者です。 1967年に設立され、錠剤加工装置、放出制御ペレット装置、自動抽出および濃縮装置、経口液体装置、注射装置、および軟膏製造装置の製造において59年以上の経験を持つ元成機械は、常に顧客のさまざまな品質要件を満たすことができます。


