
Introduction à la validation des systèmes informatiques et au 21 CFR Partie 11
GAMP, formulé par l'ISPE, et les BPF ne sont pas les mêmes, il n'appartient pas aux normes et standards obligatoires, mais plutôt à un guide de la méthodologie théorique et pratique. Parce qu'il n'appartient pas à la réglementation, et que l'ISPE n'appartient pas à une autorité de certification, l'affirmation dans GAMP : Toute revendication qui "a passé la certification GAMP" ou "a été approuvée par GAMP" est inappropriée.
De nombreuses théories et concepts proposés par GAMP5 sont encore très scientifiques et raisonnables. Bien qu'il ne fasse pas partie de la législation, il constitue actuellement la principale référence pour la validation des systèmes informatisés dans l'industrie pharmaceutique internationale, et c'est le guide réglementaire le plus important en matière d'automatisation pharmaceutique.
Processus
La validation des systèmes informatiques ne se limite pas seulement à l'utilisation du système de processus. La validation du nouveau système doit commencer dès la phase de définition et de conception du système et se terminer à une étape inutile. Le cycle de vie de la validation du système (SVLC) doit être accompagné du cycle de vie du développement du système (SDLC).
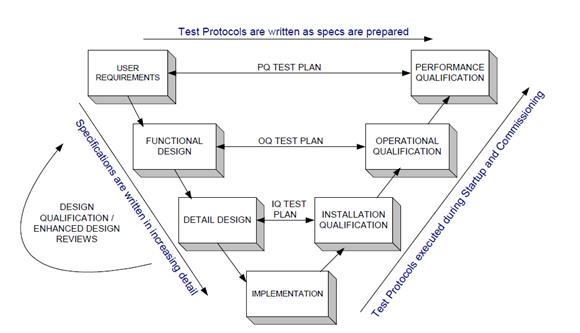
Le cycle de vie du développement système peut être divisé en huit étapes suivantes :
1、 Recherche de faisabilité
2、 Plan de projet
3、 Définition des exigences
4、 Conception du système
5、 Test du système
6、 Acceptation et confirmation du système
7、 Utilisation et maintenance
8、 Retraite du système
Infrastructure
Classification des logiciels de systèmes informatisés GAMP 5
classe 1 : Logiciels d'infrastructure
classe 3 : Produits non configurés
classe 4 : Produits configurés
classe 5 : Application personnalisée
Classification du matériel de système informatisé
classe 1 : Composants matériels standard (À l'heure actuelle, la plupart des types de matériel utilisés)
classe 2 : Composants matériels sur mesure (Ce matériel est conçu pour répondre à des besoins spécifiques et complète les composants matériels standard)
Validation
Acceptation et validation du système, lorsque les systèmes informatiques finaux et les fichiers associés sont envoyés à l'utilisateur, qui sont installés dans l'environnement de l'utilisateur et pour évaluer la justesse de ses fonctions.
La qualification ("Qualification d'installation", "Qualification d'exploitation" et "Qualification de performance") est un test complet et systématique du comportement du système informatique avant son utilisation réelle, ce qui affecte directement la qualité d'utilisation des systèmes informatiques. C'est-à-dire que la "Qualification" est le dernier maillon de l'assurance qualité du système informatique. Bien qu'une partie de la "Qualification" soit en cours dans les mêmes conditions de test unitaire et de test d'assemblage, la "Qualification" reste néanmoins nécessaire.
"Qualification" réalisée par les utilisateurs.
Activités clés lors de la qualification
1、 Exécution des protocoles approuvés
2、 Observer les résultats par l'exécution du protocole
3、 Documenter les observations
4、 Rédiger le rapport d'exécution
5、 Approuver le rapport, ou suivre le processus de contrôle des modifications pour réexécuter le protocole (modifié ou approuvé)
21 CFR Partie 11

Yenchen est capable de fournir une conformité documentaire avec 21 CFR Part 11.
CFR : Code des règlements fédéraux
21 CFR Part 11 est le chapitre 21 du Code des règlements fédéraux des États-Unis, paragraphe 11. Le principal objectif de ce règlement est de développer des dispositions spécifiques concernant les enregistrements électroniques et les signatures électroniques.
21 CFR Partie 11
Dossiers électroniques;Signatures électroniques
Sous-partie A – Dispositions générales
11.1 Champ d'application
11.2 Mise en œuvre
11.3 Définitions
Sous-partie B – Dossiers électroniques
11.10 Contrôles pour systèmes fermés
11.30 Contrôles pour systèmes ouverts
11.50 Manifestations de signature
11.70 Lien signature/dossier
Sous-partie C – Signatures électroniques
Exigences générales
Signatures électroniques et contrôles
Contrôles pour les codes d'identification/mots de passe
Yenchen est capable de fournir les services ci-dessus.
Référence : GAMP5 et 21 CFR Partie 11
Introduction de la validation des systèmes informatiques et de la partie 11 du 21 CFR | Machines à comprimés et de stérilisation - Équipement de fabrication pharmaceutique | Yenchen
Située à Taïwan depuis 1967, YENCHEN MACHINERY CO., LTD. est un fournisseur d'équipements de fabrication pharmaceutique dans l'industrie pharmaceutique. Leur principal équipement de fabrication et de traitement comprend des stérilisateurs à air chaud, des machines d'extrusion, des machines de revêtement et de compression de comprimés, des machines de fabrication de granulés et des équipements de fabrication de formes posologiques solides orales, qui sont vendus dans plus de 70 pays et répondent aux normes internationales.
Yenchen a été établi en 1967, nos produits et services sont largement utilisés dans les domaines pharmaceutique, alimentaire, biotechnologique, chimique et cosmétique, qui comprennent la ligne de dosage solide, la ligne de production de machines à granulés, la ligne de sirop, la ligne d'injection, la ligne de pommade, ainsi que des équipements clés en main pour l'extraction et la concentration.
Yenchen offre à ses clients des équipements de fabrication pharmaceutique de haute qualité depuis 1967. Grâce à une technologie avancée et à 59 ans d'expérience, Yenchen s'assure que les demandes de chaque client sont satisfaites.


