
Introducción a la Validación de Sistemas Informáticos y la Parte 11 del CFR 21
GAMP, formulado por la ISPE, y GMP no son lo mismo, no pertenece a las normas y estándares obligatorios, sino que es una guía para la teoría y la metodología de práctica. Debido a que no pertenece a la regulación, y la ISPE no es una autoridad de certificación, la afirmación en GAMP: Cualquier afirmación que "ha pasado la certificación GAMP" o "ha sido aprobada por GAMP" es inapropiada.
Muchas teorías y conceptos propuestos en GAMP5 siguen siendo muy científicos y razonables. Aunque no forma parte de la legislación, actualmente es la principal referencia para la validación de sistemas computarizados en la industria farmacéutica internacional, y es la guía regulatoria de automatización farmacéutica más importante.
Proceso
La validación de los sistemas informáticos no se limita únicamente al uso del sistema de procesos. La validación del nuevo sistema debe comenzar desde la fase de definición y diseño del sistema y finalizar en la etapa inútil. El Ciclo de Vida de Validación del Sistema (SVLC) debe ir acompañado del Ciclo de Vida de Desarrollo del Sistema (SDLC).
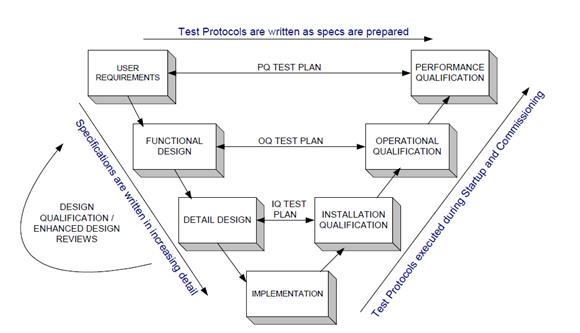
El Ciclo de Vida del Desarrollo del Sistema se puede dividir en las siguientes ocho etapas:
1、 Investigación de viabilidad
2、 Plan de proyecto
3、 Definición de requisitos
4、 Diseño del sistema
5、 Prueba del sistema
6、 Aceptación y confirmación del sistema
7、 Uso y mantenimiento
8、 Retiro del sistema
Infraestructura
Clasificación de Software de Sistemas Computarizados GAMP 5
clase 1: Software de Infraestructura
clase 3: Productos No Configurados
clase 4: Productos Configurados
clase 5: Aplicación Personalizada
Clasificación de Hardware de Sistemas Computarizados
clase 1: Componentes de Hardware Estándar (En la actualidad, la mayoría de todos los tipos de hardware utilizados)
clase 2: Componentes de Hardware de Construcción Personalizada (Este hardware está diseñado para satisfacer necesidades especiales y es un complemento a los componentes de hardware estándar)
Validación
Aceptación y validación del sistema, cuando los sistemas informáticos finales y los archivos relacionados se envían al usuario, que se instalan en el entorno del usuario y se evalúa la corrección de sus funciones.
La "Calificación" ("Calificación de Instalación", "Calificación de Operación" y "Calificación de Rendimiento") es una prueba completa y sistemática del comportamiento del sistema informático antes de su uso real, lo que afecta directamente la calidad de uso de los sistemas informáticos. Es decir, la "Calificación" es el último eslabón de la garantía de calidad del sistema informático. Aunque algunas partes de la "Calificación" están en progreso bajo las mismas condiciones de prueba de unidad y prueba de ensamblaje, la "Calificación" sigue siendo necesaria.
"Calificación" realizada por los usuarios.
Actividades clave durante la calificación
1、 Ejecutar los protocolos aprobados
2、 Observar los resultados a través de la ejecución del protocolo
3、 Documentar las observaciones
4、 Escribir el informe de ejecución
5、 Aprobar el informe, o seguir el proceso de Control de Cambios para re-ejecutar el protocolo (modificado o aprobado)
21 CFR Parte 11

Yenchen puede proporcionar cumplimiento documental con 21 CFR Parte 11.
CFR: Código de Regulaciones Federales
21 CFR Parte 11 es el Capítulo 21, párrafo 11 del Código de Regulaciones Federales de los Estados Unidos. El propósito principal de esta regulación es desarrollar disposiciones específicas sobre registros electrónicos y firmas electrónicas.
21 CFR Parte 11
Registros Electrónicos; Firmas Electrónicas
Subparte A – Disposiciones Generales
11.1 Alcance
11.2 Implementación
11.3 Definiciones
Subparte B – Registros Electrónicos
11.10 Controles para sistemas cerrados
11.30 Controles para sistemas abiertos
11.50 Manifestaciones de firma
11.70 Vínculo de firma/registro
Subparte C – Firmas Electrónicas
Requisitos generales
Firmas electrónicas y controles
Controles para códigos de identificación/contraseñas
Yenchen puede proporcionar los servicios anteriores.
Referencia: GAMP5 y 21 CFR Parte 11
Introducción a la Validación de Sistemas Informáticos y 21 CFR Parte 11 | Máquinas de Tabletas y Esterilización - Equipos de Fabricación Farmacéutica | Yenchen
Ubicada en Taiwán desde 1967, YENCHEN MACHINERY CO., LTD. ha sido un proveedor de equipos de fabricación farmacéutica en la industria farmacéutica. Su principal equipo de fabricación y procesamiento incluye esterilizadores de aire caliente, máquinas de extrusión, máquinas de recubrimiento y compresión de tabletas, máquinas de fabricación de gránulos y equipos de fabricación de dosis sólidas orales, que se venden a más de 70 países cumpliendo con los estándares internacionales.
Yenchen se estableció en 1967, nuestros productos y servicios se utilizan ampliamente en los campos farmacéutico, alimentario, biotecnológico, químico y cosmético, que incluyen línea de dosificación sólida, línea de producción de máquinas de pellets, línea de jarabes, línea de inyección, línea de ungüentos, equipos llave en mano de extracción y concentración.
Yenchen ha estado ofreciendo a los clientes equipos de fabricación farmacéutica de alta calidad desde 1967, tanto con tecnología avanzada como con 59 años de experiencia, Yenchen asegura que se satisfagan las demandas de cada cliente.


